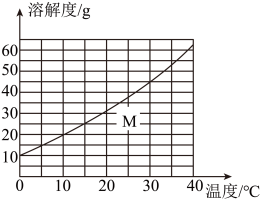
温度/℃ | 0 | 10 | 20 | 30 | 40 | |
溶解度/g | 氯化钠 | 35.7 | 35.8 | 36 | 36.5 | 37 |
碳酸钠 | 6 | 16 | 18 | 36.5 | 50 | |
硝酸钾 | 13.3 | 20.9 | 31.6 | 45.8 | 63.9 | |
①德国生物学家韦尔斯泰特最早发现了叶绿素中含有镁,这里的镁是指。
a.单质 b.原子 c.元素
②1792年,人类首次加热苦土(氧化镁)和木炭混合物制得金属镁,同时生成二氧化碳,该反应体现了木炭的性。

①图1中x的数值为。已知元素在周期表中的周期序数等于该元素原子具有的电子层数,则镁位于周期表的第周期。
②图2中的Mg(NO3)2可由A与发生中和反应而获得。
③写出图3中总反应的化学方程式。
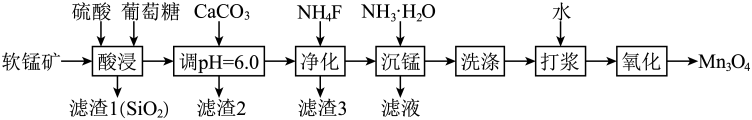
C6H12O6+12MnO2+12H2SO4=12MnSO4+6CO2↑+18X,X的化学式为。
其他金属氧化物和硫酸反应生成相应的硫酸盐,写出Fe2O3和硫酸反应的化学方程式。
金属离子 | Fe3+ | Al3+ | Mg2+ | Mn2+ |
开始沉淀时pH | 1.6 | 3.0 | 8.9 | 8.1 |
完全沉淀时pH | 2.8 | 4.7 | 10.9 | 10.1 |
则滤渣2的主要成分是。

①蒸煮时往浆水中加入草木灰(主要成分K2CO3)和石灰水,成浆效果更佳。写出K2CO3和Ca(OH)2反应的化学方程式。
②现代壁纸、包装纸要求纸张具有阻燃性,氢氧化铝是常见的阻燃剂,其受热至220℃开始分解生成氧化铝和水,反应过程中(填“吸收”或“放出”)热量,同时生成的固体覆盖在纸张表面,起到作用。
①排版时,需用小火烘烤模板上的石蜡,使其熔化,烘烤过程中温度不能过高的原因是。
②用墨印刷的字画能够长久保存而不褪色的原因是。
补铁药片中铁元素的价态是什么?糖衣的作用是什么?
【查阅资料】
①该补铁剂不溶于水,但能溶于人体中的胃液。
②KSCN溶液遇Fe3+显示红色,遇到Fe2+不变色。
③Fe3+遇K3[Fe(CN)6]溶液不变色,Fe2+遇K3[Fe(CN)6]溶液会生成蓝色沉淀。
【实验探究】
甲同学向碾碎后的补铁剂中加入足量的水,分别滴加KSCN溶液和K3[Fe(CN)6]溶液均未观察到明显现象,可能的原因是。
![]()
①在实验室里碾碎补铁剂可在(填仪器名称)中进行,试剂X是。
②加入KSCN后溶液变为浅红色,说明溶液①中含有(填离子符号)。
③能证明溶液①中含有Fe2+的实验现象是。
该药片外表包有一层糖衣,除了包装药物外,糖衣的另一个作用可能是。
医生建议在服用补铁剂时,同时服用维生素C确保补铁效果,猜想维生素C能将Fe3+转化为Fe2+ , 以利于人体吸收,请设计实验验证这一猜想(须使用的试剂有Fe2(SO4)3溶液、维生素C、KFe(CN)6溶液)。
①计算所取CuSO4溶液的质量分数。
②如没有对所得沉淀进行洗涤,则CuSO4溶液的质量分数将 (填“偏大”“偏小”或“无影响”)。